具有极性共价键的弱电解质溶于水时,其分子可以微弱电离出离子;同时,溶液中的相应离子也可以结合成分子。在一定条件下,弱电解质的离子化速率(即电离速率)等于其分子化速率(即结合速率)。
弱电解质的电离平衡总结
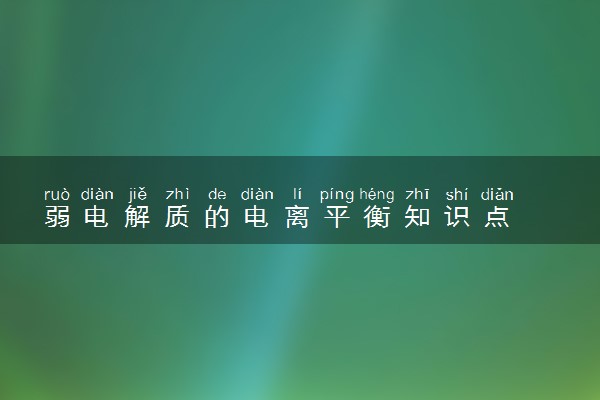
1.弱电解质与化合物类型的关系
强电解质主要是大部分离子化合物及某些共价化合物,弱电解质主要是某些共价化合物。
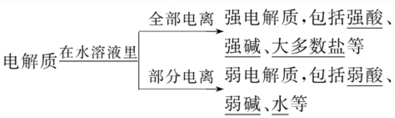
2.弱电解质的电离概念
(1)电离平衡的建立
在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
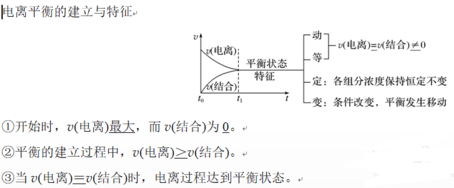
3.外因对电离平衡的影响
(1)浓度:在一定温度下,同一弱电解质溶液,浓度越小,越易电离。
(2)温度:温度越高,电离程度越大。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。
(4)化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离方向移动。
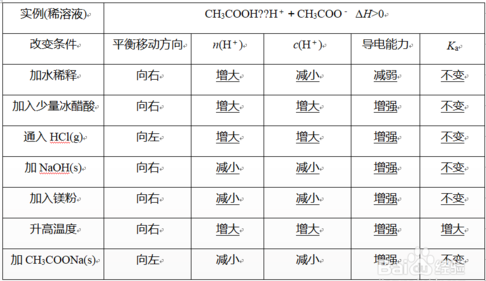
4.例子:下面以0.1 mol·L-1 CH3COOH溶液为例,下图是外界条件对CH3COOH=CH3COO-+H+ΔH>0的影响
电离平衡常数特点
(1)电离平衡常数与温度有关,与浓度无关,升高温度,K值增大。
(2)电离平衡常数反映弱电解质的相对强弱,K越大,表示弱电解质越易电离,酸性或碱性越强。
例如,在25 ℃时,K(HNO2)=4.6×10-4,K(CH3COOH)=1.8×10-5,因而HNO2的酸性比CH3COOH强。
(3)多元弱酸的各级电离常数的大小关系是K1≫K2≫K3……,故其酸性取决于第一步电离。
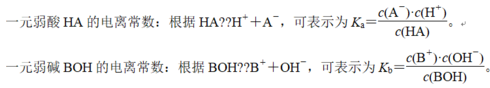
弱电解质电离平衡
有具有极性键的共价化合物如:弱酸(CH3COOH)、弱碱(NH3·H2O)、水
特别:HgCl2是共价化合物且共价键极强,属于弱电解质。
影响电离平衡的因素
1.温度:电离过程是吸热过程,温度升高,平衡向电离方向移动。
2.浓度:弱电解质分子浓度越大,电离程度越小。
3.同离子效应:在弱电解质溶液中加入含有与该弱电解质具有相同离子的强电解质,从而使弱电解质的电离平衡朝着生成弱电解质分子的方向移动,弱电解质的解离度降低的效应称为同离子效应。
4.化学反应:某一物质将电离出的离子反应掉而使电离平衡向正方向(电离方向)移动。
5.弱酸的电离常数越大,达到电离平衡时电离出的H+越多,酸性越强;反之,酸性越弱。多元弱酸的电离是分步进行的,每一步电离都有各自的电离常数,且各级电离常数逐级减小,一般相差较大,所以其水溶液中的 H+主要是由第一步电离产生的。
6.对弱碱来说,也有类似弱酸的规律。
7.分步电离中,越后面电离出的离子数越少。
电离度公式
α(电离度)=已电离的分子/原有分子数×100%
水的电离:
精确的实验证明,水是一种极弱的电解质,它能微弱的电离,生成H3O+(水合氢离子,即H+·H2O) 和OH-:
2H2O<==> H3O++ OH-
可简写为:H2O<==> H++ OH-
Kw叫水的离子积常数,简称为水的离子积。
在25℃时,水中H+溶度和OH-溶度都是1x10-7mol/L,所以
Kw=c(H+)·c(OH-)=1x10-14
Kw值随温度升高而变大
100℃时,Kw=5.5x10-14
判断电解强弱方法:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验
2.在相同浓度、相同温度下,比较反映速率的快慢,如将Zn投到等浓度的盐酸与醋酸中比较,结果前者比后者快。